15 de agosto de 2022

Quando falamos a palavra “ferrítico”, podemos associar a fase do aço Ferrita, o que faz sentido, uma vez que a classe de aços ferríticos possuem esse nome por conta da sua fase estável, desejada para o trabalho. Este aço é uma opção viável em determinadas aplicações, em comparação aos aços martensíticos ou austeníticos. Neste texto vamos avaliar um pouco sobre o que é esse aço e onde podemos aplicar.

Sumário
O aço ferrítico, classificado pela norma AISI, faz parte da série 400, junto com os aços martensíticos. Já os aços austeníticos, que apresentam em sua composição química o Ni, um elemento estabilizador da austenita, e por isso a os aços da série 300 são considerados austeníticos [1].
A diferença entre os aços inoxidáveis martensíticos e ferríticos está em sua composição química. Uma vez que os aços inoxidáveis martensíticos são processados de maneira a se obter a martensita, logo, passam por têmpera. Já os aços inoxidáveis ferríticos apresentam elementos estabilizadores da ferrita, tais como Ti ou Al.
Primeiro vamos avaliar o que é a Ferrita, a fase que compõe o aço ferrítico.
A base das ligas de aços inoxidáveis é, obviamente, o ferro. O ferro, como dito, solidifica como uma liga BCC antes de se transformar na austenita FCC mais densa em temperaturas mais baixas e se baixarmos ainda mais a temperatura, ele reverte para a estrutura BCC. É correto supor a partir disso que a energia livre de ambas as estruturas é próxima. Ligar elementos que promovem uma estrutura sobre a outra pode, portanto, alterar qual predomina [2, 3].
O elemento que introduz a capacidade de formar o filme passivo que torna o aço inoxidável resistente à corrosão, o cromo, tem a característica de estabilizar a estrutura BCC. À medida que o cromo é adicionado ao ferro, a faixa de temperatura na qual a austenita é estável diminui até que, em cerca de 12% de cromo, a ferrita é estável em todas as temperaturas [1-3].
Este é, coincidentemente, o nível aproximado de cromo necessário para evitar que as ligas enferrujem em condições ambientais, mas esse efeito não está relacionado se a estrutura é BCC ou FCC [1].
Enquanto o cromo é o principal elemento de liga promotor de ferrita, outros elementos têm efeitos semelhantes, mas nenhum produz a qualidade de inox. Silício, alumínio, molibdênio, tungstênio, nióbio e titânio favorecem a ferrita [4, 5].
Carbono, nitrogênio, manganês, níquel e cobre não expandem a faixa de temperatura na qual a austenita existe. Elementos que são insolúveis em ferro em temperaturas formadoras de austenita, como as impurezas fósforo, enxofre e oxigênio, não têm influência sobre qual fase é favorecida. Novamente, deve-se enfatizar que a influência de um elemento de liga na estrutura tem influência zero em sua influência na resistência à corrosão [5].
Os elementos que promovem a ferrita sobre a austenita também têm o efeito, em temperaturas ainda mais baixas, de promover compostos intermetálicos geralmente compostos de ferro, cromo e alguns desses elementos de liga [5].
Em aço inoxidável, carbono e nitrogênio podem ser impurezas prejudiciais. Ambos são bastante solúveis em ligas de ferro-cromo fundido e bastante solúveis na ferrita a altas temperaturas. Esta solubilidade diminui exponencialmente com a temperatura, de modo que é essencialmente zero à temperatura ambiente [5].
Esses elementos têm tamanhos atômicos pequenos em comparação com o ferro e o cromo e, quando dissolvidos, se acomodam em locais intersticiais dentro da matriz BCC. Esses átomos de soluto intersticiais distorcem profundamente a estrutura. Eles são muito mais solúveis na estrutura FCC, que, embora mais densa, tem espaços intersticiais maiores, então estabilizam essa estrutura. Para preservar a estrutura da ferrita, carbono e nitrogênio devem ser eliminados [5].
Existem razões adicionais para eliminar carbono e nitrogênio. Durante o resfriamento, à medida que esses elementos se tornam cada vez menos solúveis, eles devem precipitar [5].
A forma termodinamicamente mais favorável em que podem precipitar é como um composto de cromo, com o qual são muito reativos. Isso ocorre nos contornos de grão, onde a nucleação é favorecida, e esgota essas regiões de cromo, tornando-as menos resistentes à corrosão. Um segundo efeito é uma perda de tenacidade devido a esses precipitados. As taxas de difusão de carbono e nitrogênio na ferrita são muito altas para evitar essa precipitação por têmpera [5].
As ligas inoxidáveis ferríticas geralmente se agrupam em baixo (10,5 a 12,0%), médio (16 a 19%) e alto (acima de 25%) cromo. Eles podem ser estabilizados ou não. A Tabela 1, abaixo, apresenta as principais ligas de aço ferrítico utilizadas na indústria.
Tabela 1 – Ligas de Aço Inoxidáveis Ferríticos mais utilizados na industria [5]
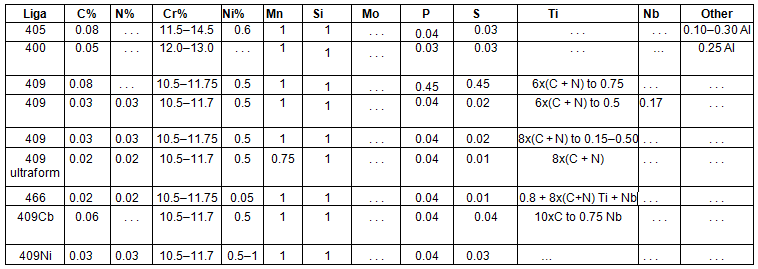
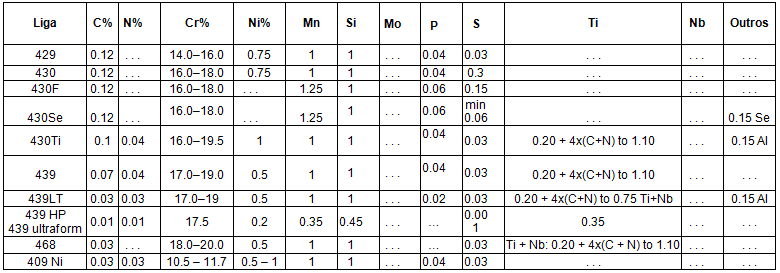
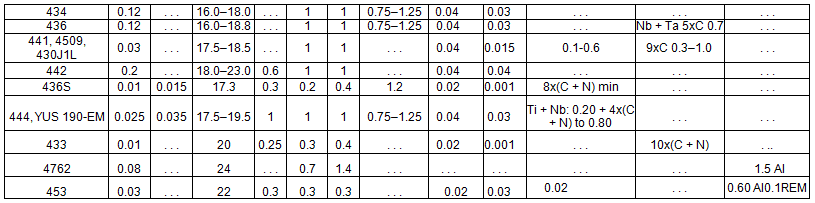
Os aços inoxidáveis ferríticos com baixo teor de cromo começaram com o desenvolvimento do MF-1, o antecessor do 409, na década de 1960. Sua excelente resistência à corrosão, comparada ao aço carbono; custo relativamente baixo; boa soldagem; e a formabilidade permitiu-lhe substituir o aço carbono aluminizado e o ferro fundido em sistemas de escape automotivos, abrindo o que acabou se tornando o maior mercado único de aço inoxidável [5].
Foi possível graças aos níveis muito baixos de carbono e nitrogênio que o processo AOD forneceu e o uso de estabilização. Assim, 409 foi uma melhoria em 405 em que o alumínio realizou uma quase estabilização, e martensita com baixo teor de carbono suprimido [5].
Os aços inoxidáveis ferríticos são bastante semelhantes em seu comportamento mecânico ao aço carbono. A principal influência do cromo é produzir algum endurecimento por solução sólida [5].
O ferro puro é um material extremamente macio com um limite de escoamento bem abaixo de ~69MPa. Essa suavidade não é vista na prática porque o aço nunca é puro [5].
O carbono tem um efeito extremamente poderoso no endurecimento, assim como o nitrogênio. A influência dos elementos de liga substitucionais também é bastante significativa. O desajuste dos átomos do soluto causa deformações na rede proporcionais à quantidade dissolvida e fornece fortalecimento através do termo de atrito da rede [6].
Este mecanismo também aumenta a temperatura de transição de impacto desfavoravelmente. Elementos que produzem um refino de tamanho de grão são a exceção a esta regra geral em aço carbono, mas a falta de uma transformação austenita-ferrita em aços inoxidáveis ferríticos estabilizados nega esse benefício para eles [1, 5, 6].
Manganês e silício são normalmente desoxidantes, mas em ligas estabilizadas com titânio, o titânio assume o papel de desoxidação para que sua presença possa ser limitada. O fósforo é praticamente impossível de refinar a partir do aço inoxidável, então sua presença em torno de 0,02% é normalmente dada, a menos que matérias-primas com baixo teor de fósforo sejam usadas como ponto de partida [5].
Os piores efeitos inibidores de tenacidade vêm de elementos intersticiais para contornos de grão: oxigênio, carbono e nitrogênio. O efeito de carbono mais nitrogênio na temperatura de transição é profundo [7].
A estabilização remove o carbono e nitrogênio intersticial, juntamente com oxigênio e enxofre, da solução. Isso não produz um grande amolecimento, no entanto, porque o próprio precipitado tem um efeito de endurecimento [5].
As propriedades mecânicas de alta temperatura dos aços inoxidáveis ferríticos são muitas vezes importantes para seu uso bem-sucedido porque sua resistência à oxidação é excelente e melhor que os austeníticos, mas sua resistência a altas temperaturas é menor que a dos austeníticos. Isso levou a um desenvolvimento considerável de propriedades de alta temperatura [5].
A resistência a altas temperaturas e a resistência à fluência são melhor atendidas pela estabilização do tamanho do grão e pela presença de nióbio em solução sólida. A adição de titânio aos aços estabilizados com nióbio estabiliza o tipo de carboneto, evitando especialmente a formação do M6C grosseiro, cujo crescimento diminui a resistência. A insolubilidade relativamente alta do TiC causa isso [5].
O nióbio é disponibilizado simultaneamente para o fortalecimento de soluções sólidas de alta temperatura [5].
A resistência à corrosão depende da química e não da estrutura, de modo que os aços inoxidáveis ferríticos se comportam da mesma forma que outros aços inoxidáveis com o mesmo teor de liga crucial [5].
Os principais elementos de liga que fornecem resistência à corrosão localizada e corrosão geral são cromo, molibdênio e nitrogênio. Como o nitrogênio é essencialmente insolúvel em ferrita, ele não pode contribuir para a resistência à corrosão dos aços inoxidáveis ferríticos como faz na austenita [1, 5].
Outros elementos de liga, como cobre e níquel, podem aumentar a resistência à corrosão em casos especiais, mas são de importância secundária em comparação com cromo e molibdênio. Da mesma forma, outros elementos podem ter um efeito negativo. Qualquer elemento que possa combinar com cromo ou molibdênio pode diminuir a resistência à corrosão pela remoção desses elementos essenciais da solução [5].
O mais notório deles é o carbono, cuja tendência a formar carbonetos de cromo faz com que as áreas ao redor desses carbonetos fiquem parcialmente empobrecidas de cromo [5].
No entanto, nitrogênio, oxigênio e enxofre também podem formar compostos de cromo e causar perda localizada de resistência à corrosão. Sulfetos de manganês, por exemplo, são quase sempre vistos como o locais da corrosão por pite [8].
Esses sulfetos crescem no estado sólido como sulfetos de cromo/manganês e esgotam o cromo em seus arredores muito próximos, convidando a corrosão a começar na interface da matriz de inclusão, onde os níveis de cromo em solução são reduzidos [9].
Outros fatores que levam à perda da resistência à corrosão localizada são a formação de fases ricas em cromo, como α’ e σ. Qualquer um destes com cerca de 50% de cromo fará com que a ferrita adjacente tenha níveis mais baixos de cromo [1, 10].
Como a ferrita tem uma estrutura não compactada, as taxas de difusão, tanto substitucionais quanto intersticiais, são cerca de duas ordens de grandeza maiores do que na austenita. Isso significa que qualquer reação deletéria de esgotamento de cromo pode acontecer mais rapidamente [5].
Para evitar a sensibilização, a precipitação de carbonetos de cromo que esgota as regiões de contorno de grão de cromo deve ser evitada. O carbono deve ser neutralizado por estabilização, ou a depleção de cromo deve ser removida por homogeneização em recozimento de caixa longa [5].
Os aços inoxidáveis ferríticos são valorizados por sua resistência ao SCC (Stress corrosion cracking, em português, Fragilização por corrosão sob tensão). Mesmo em ambientes que causam pitting, a etapa de iniciação normal para SCC, os aços inoxidáveis ferríticos recozidos não sofrem SCC desde que elementos de liga como níquel, cobre e cobalto sejam mantidos abaixo de 0,5% no agregado [5].
A conformação a frio dessas ligas podem aumentar sua dureza acima de 20 a 22 HRC, pode torná-los suscetíveis tanto ao SCC quanto a fragilização por hidrogênio. As ligas superferríticas mais altamente ligadas são ainda suscetíveis à fragilização por hidrogênio na condição recozida [11]. Tal como acontece com os aços inoxidáveis martensíticos, esta suscetibilidade é máxima próxima à temperatura ambiente e diminui com o aumento da temperatura, ao contrário dos austeníticos, que têm sua suscetibilidade máxima acima da temperatura ambiente [5].
Isso limita a capacidade dessas ligas de empregar proteção catódica com segurança a -0,80 Vsce, ponto em que a corrosão na água do mar é, se não eliminada, reduzida a níveis muito baixos [12].
Conteúdo não pode ser publicado ou redistribuído sem prévia autorização. Elaboração e Edição: Thiago Cortiz e Renata Brandolin

Referências
[1] PADILHA, A.F.; GUEDES, L.C. Aços inoxidáveis austeniticos-microestrutura e propriedades, Hermus Editora Ltda, 1994.
[2] CALLISTER, W. D., Ciência e Engenharia de Materiais: Uma Introdução. John Wiley & Sons, Inc., 2002
[3] VAN VLACK, L. H., Princípio de Ciência e Tecnologia dos Materiais, 4ª. ed. Dio de Janeiro, Campus, 1984.
[4] AISC American Institute of Steel Construction Design Guide 30: Structural Stainless Steel.; 2012.
[5] McGUIRE, M., Stainless Steels for Design Engineers, Ohio, ASM International, 2008.
[6] H.W. Paxton, Alloying, ASM, 1998, p 213
[7] H. Abo et al., Stainless Steel ‘77
[8] T. Suter, E. Webb, H. Bohni, and R. Alkire, Pit Initiation in I M NaCl With and Without Mechanical Stress, J. Electrochem. Soc., Vol 148 (No. 5), 2001, B174
[9] M. Ryan, D. Williams, R. Chater, B. Hutton, and D. McPhail, Why Stainless Steel Corrodes, Nature, Vol 412, 2002, p 770
[10] PINEDO, Carlos Eduardo. Tratamentos Térmicos e Superficiais dos Aços. [S. L.]: Blucher, 2021.
[11] J. Grubb, “Hydrogen Embrittlement of Superferritic Stainless Steels,” paper presented at 1984 ASM Int’l Conference on New Developments in Stainless Steel Technology, Detroit, September 1984
[12] J. Grubb and J. Maurer, “Use of Cathodic Protection With Superferritic Stainless Steels in Seawater,” paper presented at Corrosion 84, New Orleans, April 1984.
ferrítico ferrítico ferrítico ferrítico ferrítico